医院动态
中医冠心病心绞痛临床研究国际数据标准发布
2019年9月18日,临床数据交换标准协会(the Clinical Data Interchange Standards Consortium,CDISC)通过其官网以及亚太、北美、欧盟地区相关新闻媒体发布公告,CDSIC首个中医学相关临床研究数据标准:《中医冠心病心绞痛治疗领域数据标准》正式发布,这也是CDISC首个以中文和英文两种语言发布的标准。在上周召开的CDISC中国交流大会上,中美双方共同庆祝了该标准的发布。
该标准开发项目于2016年1月正式启动,由中国中医科学院西苑医院、美国国立癌症研究所-企业词汇服务部 (NCI-EVS)及CDISC志愿者合作开发,开发过程完全遵循CDISC标准开发标准操作规程,并得到了CDISC中国协调委员会(C3C)和其它中医单位的支持。标准以治疗领域用户指南(Therapeutic Area User Guides ,TAUG)的形式发布,描述了与冠心病心绞痛相关的最常见的生物医学概念以及呈现此类数据所需的元数据及其示例。其内容涵盖中西医学对冠心病心绞痛的认识,七种冠心病心绞痛中医证型、心电图运动负荷试验及超声心动图研究数据列表模型(Study Data Tabulation Model,SDTM)、中医证型评价分析数据模型(Analysis Data Model, ADaM)及常见中医学术语定义。该标准将指导中医药临床研究数据的标准化处理,加快监管审评过程,从而缩短药物上市时间。作为CDISC首个中医学相关数据标准,它的发布将促进国际社会对中医学的认识,并对中医药临床研究的国际化发挥十分积极的影响。
相关信息介绍:
CDISC成立于1997年(当时为志愿者组织),2000年正式成立为非盈利组织,经过20多年的发展,CDISC发布了一系列规范临床和非临床研究的数据标准,涉及方案的制定、数据的收集、报告、分析全流程,促进生物医药研究和相关卫生健康领域数据信息的互通性。CDISC用户遍及全球90多个国家,目前有超过450家会员单位,美国食品药品管理局(FDA)、欧洲药品管理署(EMA)和日本医药品和医疗器械综合机构(PMDA)、国家药品监督管理局(NMPA)等ICH成员单位强制要求或推荐业界使用CDISC标准。
中国中医科学院西苑医院中药临床疗效和安全性评价国家工程实验室于2015年12月经国家发展和改革委员会批复建设,建立符合国际规范的临床评价共性技术平台是工程实验室建设的重要目标之一。在当前国家实施创新发展战略、深化药品医疗器械审评审评制度改革的背景下,我院积极与临床数据交换标准协会(CDISC)合作,先后派两名研究人员赴美学习数据标准开发流程并启动了中医冠心病心绞痛临床研究数据标准合作开发项目,在国家药品监督管理局药品审评中心支持下,我院于2018年9月举办了“CDISC标准及其开发与实施”学术研讨会(详见我院2018年9月10日相关报道),期望能服务行业的发展,支撑高质量的临床研究开展,促进药品医疗器械审评审批信息化建设。
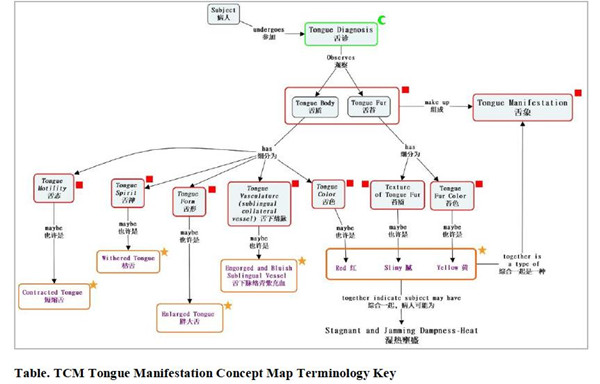
图1 TAUG中关于舌象诊断的概念图

图2 CDISC中国2019交流大会:CDISC副主席Rhonda Facile宣布首个中医数据标准发布

图3 CDISC中国2019交流大会:西苑医院陆芳教授介绍中医数据标准及中医术语
图4 CDISC中国2019交流大会:CDISC中国协调委员会(C3C)主席Victor介绍中医数据标准模型特点
西苑医院