医学伦理
伦理审查申请流程
1、资料准备:初始全套纸质资料形式审查(请于伦理办公室面审,周一到周三);
2、电子资料上传系统:全部资料请主研签字、签署日期及厂家(如涉及)盖章后电子版上传系统,可通过“菜单栏伦理系统”跳转至伦理系统,或通过网址https://www.xiyuanirb.com:90/ 登录(该网址自助申请账号,伦理办公室审核后可登录,如果账密被锁,请伦理秘书协助解锁)
3、受理成功后,请登录系统下载打印纸质版自存,伦理委员会不再接收纸质材料;
4、审查:按照要求参加会议审查,进行答辩,或经过简易审查,按照要求完善方案及相关资料;
5、获得批件(递交纸质资料后,进入会审/简易审查后三天请查阅系统),系统获知电子批件后两天可领取纸质版批件;
6、递交跟踪审查申请及资料(批件到期前3个月,伦理秘书会友情提示!)。
信息通知:
附件1:参考法规
《药物临床试验质量管理规范(GCP)》2020年
《医疗器械临床试验质量管理规范》(2022年)
《涉及人的生物医学研究伦理审查办法》(2016年)
《涉及人的生命科学和医学研究伦理审查办法》(2023年)
《科技伦理审查办法(试行)》(2023年)
《涉及人的健康相关研究国际伦理准则》(CIOMS,2016年)
《赫尔辛基宣言》(世界医学会,2024年)
《中医药临床研究伦理审查管理规范》(2010年)
《药物临床试验伦理审查工作指导原则》(CFDA,2010年)
《保健食品注册与备案管理办法》(NMPA, 2016年)
《生物医学研究审查伦理委员会操作指南》(世界卫生组织,2000年)
《北京市实验动物管理条例》(2021)
《医疗卫生机构开展研究者发起的临床研究管理办法》2024
附件2:伦理委员会工作制度
一、中国中医科学院西苑医院医学伦理委员会依据我国《药物临床试验质量 管理规范(GCP)》(2020 年)、《医疗器械临床试验质量管理规范》(2022 年)、《涉及人的生命科学和医学研究伦理审查办法》 (2023 年)、《医疗卫生机构开展研究者发起的临床研究管理办法》(2024 年)、卫健委《涉及人的生物医学研究伦理审查办法》(2016 年)、《保健食品注册与备案管理办法》(2016 年)、世界卫生组织《生物医学研究审查伦理委员会操作指南》(2000 年)、CIOMS《涉及人的健康相关研究国际伦理准则》(2016 年)、国家中医药管理局 2010 年颁布《中医药临床研究伦理审查管理规范》、《药物临床试验伦理审查工作指导原则》(2010 年)和世界医学会《赫尔辛基宣言》建立,其职责是通过独立地审查、同意、跟踪审查试验方案及相关文件、获得和记录受试者知情同意所用的方法和材料等,确保受试者的权益、安全受到保护。
医学动物试验遵循《实验动物管理条例》中华人民共和国国家科学技术委员会令第2号(1988)、《北京市实验动物管理条例》(2021)、《实验动物福利伦理审查指南》(2018年)进行审查,其目的是为了提高实验动物管理工作质量和水平,维护动物福利,促进人与自然和谐发展,适应科学研究、经济建设和对外开放的需要,并规范实验动物伦理审查和实验动物从业人员的职业行为。
二、依据我国GCP有关伦理委员会组成人员的规定,中国中医科学院西苑医院负责伦理委员会成员的筛选和/或招募、任免事项,以医院正式文件形式公布委员遴选及选举结果,并向药品监督管理部门和卫生主管部门备案。伦理委员会成员是兼职的。伦理委员会成员任期五年,可以连任,换届的新成员不少于1/5。伦理委员会的组成和工作相对独立,不受任何参与试验者的影响。根据伦理审查工作需要,必要时可对伦理委员会成员进行调整,并向药品监督管理部门及法规要求的相关网站备案。
三、伦理委员会分组运行,统一管理,分为A/B/C三组,其中A,B组是审查涉及人体的研究项目,C组审查实验动物项目。各组独立审查,不设备选委员及替补委员。伦理委员会法定到会人数为组成该组常任委员总数的半数加1,并不得少于NMPA《药物临床试验质量管理规范》关于伦理委员会组成人员最低人数(5人)的要求或卫计委《涉及人的生物医学研究伦理审查办法》关于伦理委员会组成人员最低人数(7人)的要求。包括医药专业人员,非医药专业人员,法律专家和其他单位的人员,并有不同性别的成员。只有参与审查的伦理委员会成员才有决定权,以投票方式作出决定,同意票超过法定到会人数的半数方可通过。审查决定可以是:同意;必要的修改后同意;不同意;终止或者暂停已同意的研究。如果存在利益冲突,该成员应从会议的决定程序中退出;该利益冲突应在审查前向伦理委员会主任说明,并作记录。
四、伦理委员会可以根据审查项目的专业,聘请或委任独立顾问。独立顾问就所提议的研究方案向伦理委员会提供专门的意见。应规定独立顾问的授权范围。
五、伦理委员会成员必须接受有关生物医学研究的伦理道德和科学方面的初始培训和继续教育,并通过考核合格表明其达到培训要求和预期目标。中国中医科学院西苑医院为医学伦理委员会成员的培训和继续教育创造条件。
六、伦理委员会成员应签署委员声明,同意公开他/她的完整姓名、职业和隶属关系;同意应要求公开其工作报酬和其他有关开支。伦理委员会成员应签署一项有关会议审议内容、申请材料、受试者信息和相关事宜的保密承诺。
七、每次伦理审查前,伦理委员会成员或聘请的独立顾问均应声明是否存在与伦理审查有关的利益冲突,保证将任何可能有关的利益冲突向伦理委员会报告。
八、伦理委员会设伦理委员会办公室负责人/主任1名,和/或专职秘书1-2名、兼职秘书若干名,兼职工作人员若干名,负责受理伦理审查申请材料、会议日程安排、会议记录、决议通知、档案管理、年度工作总结以及经费管理等工作。
九、对于北京市伦理审查联盟项目的审查,作为北京市伦理审查联盟成员单位,应遵照相关制度和要求执行(《北京市深化医学伦理审查结果互认有关工作的若干措施》京卫科教[2023]37号)。
附件3:第十届医学伦理委员会成员及名单
| 姓名 | 性别 | 专业背景 | 职称/职务 | 工作单位 |
| 徐 浩 | 男 | 中医心血管 | 主 任 医 师/ 纪委书记、副院长 | 中国中医科学院 西苑医院 |
| 訾明杰 | 女 | 中医针灸 | 主任医师/ 伦理办公室主任 | 中国中医科学院 西苑医院 |
| 朱尧武 | 男 | 中医肿瘤学 | 主任医师/ 肿瘤科副主任 | 中国中医科学院 西苑医院 |
| 杜宝俊 | 男 | 中医男科 /妇科 | 主任医师 | 中国中医科学院 西苑医院 |
| 唐旭东 | 男 | 中医血液病学 | 主任医师/ 血液病科副主任 | 中国中医科学院 西苑医院 |
| 韩 梅 | 女 | 法 学 | 律 师 | 德恒律师事务所 |
| 杨建英 | 女 | 国际关系 | 教 授 | 国际关系学院 |
| 李琦 | 男 | 检验医学 | 主任技师/ 检验科主任 | 中国中医科学院 西苑医院 |
| 李培红 | 女 | 中药学 | 主任药师 | 中国中医科学院 西苑医院 |
| 高善厚 | 男 | 工运与工会建设 | 原审计处处长 | 中国中医科学院 西苑医院 |
| 易亮 | 男 | 中医急重症 | 主 任 医 师/ 重症监护病房副主任 | 中国中医科学院 西苑医院 |
| 鞠建庆 | 男 | 中医心血管 | 副主任医师 | 中国中医科学院西苑医院 |
| 王京京 | 女 | 针灸推拿学 | 主任医师/针灸医院痛症科兼脾胃病科主任 | 中国中医科学院针灸研究所 |
| 贾小强 | 男 | 中医外科 | 主任医师 | 中国中医科学院西苑医院 |
| 李荣辉 | 女 | 中医儿科学 | 主任医师 | 中国中医科学院西苑医院 |
| 唐今扬 | 男 | 中医痹病学 | 主任医师/ 风湿病科副主任 | 中国中医科学院西苑医院 |
| 伊博文 | 男 | 药 学 | 主任药师/药学部主任 | 中国中医科学院西苑医院 |
| 苏根元 | 男 | 器械管理 | 主任技师 | 中国中医科学院西苑医院 |
| 陈晓燕 | 女 | 护理学 | 主任护师 | 中国中医科学院西苑医院 |
| 尹秀云 | 女 | 哲 学 | 副教授 | 北京大学医学部 |
| 杨 健 | 男 | 法 学 | 律 师 | 北京协理律师事务所 |
| 高 瞻 | 男 | 中医外科学 | 主任医师/泌尿科主任 | 中国中医科学院西苑医院 |
| 刘红梅 | 女 | 中医脑病 | 主任医师 | 中国中医科学院西苑医院 |
| 岗卫娟 | 女 | 针灸推拿学 | 研究员/针灸循证 医学中心主任 | 中国中医科学院针灸研究所 |
| 黄新华 | 男 | 法 学 | 副教授 | 清华大学法学院 |
| 任钧国 | 男 | 中药药理学 | 研究员/ 基础研究室主任 | 中国中医科学院 西苑医院 |
| 尹秀云 | 女 | 哲 学 | 副教授 | 北京大学医学部 |
| 杨 健 | 男 | 法 学 | 律 师 | 北京协理律师事务所 |
| 胡晓梅 | 女 | 中医血液病学 | 主任医师/ 血液病研究所副所长 | 中国中医科学院 西苑医院 |
| 赵晋宁 | 男 | 动 物 医 学 | 研 究 员 | 中国中医科学院 西苑医院 |
| 梁 虹 | 女 | 动物学,法学 | 律师、副研究员 | 北京中银律师事务所 |
| 丛伟红 | 女 | 中西医结合 | 研究员/ 心血管实验室副主任 | 中国中医科学院 西苑医院 |
| 刘剑刚 | 男 | 中药药理学 | 研究员 | 中国中医科学院 西苑医院 |
| 郭 浩 | 男 | 中药药理学 | 副研究员/安全性实验室副主任 | 中国中医科学院西苑医院 |
| 马丽娜 | 女 | 中药药理学 | 副研究员 | 中国中医科学院西苑医院 |
| 李 磊 | 男 | 中药药理学 | 副研究员 | 中国中医科学院西苑医院 |
附件5:伦理审查申请/报告指南
中国中医科学院西苑医院医学伦理委员会
EC of Xi Yuan Hospital of China Academy of Chinese Medical Sciences
伦理审查申请/报告指南
为指导主要研究者/申办者、课题负责人提交药物/医疗器械/保健食品/临床科研课题的伦理审查申请/报告,特制订本指南。
一、提交伦理审查的研究项目范围
下列范围的研究项目应依据本指南提交伦理审查申请报告:
(1)药物临床试验;
(2)医疗器械临床试验、体外诊断试剂临床试验;
(3)医疗新技术的临床研究、或引进应用;
(4)涉及人体受试者临床研究的科研课题(项目);
(5)保健食品临床试食试验。
二、伦理审查申请/报告类别
1 初始审查
初始审查申请:是指首次向伦理委员会提交的审查申请。符合以上范围的研究项目,应在研究申请前、临床开始前提交伦理审查初始申请,获得本伦理委员会批准后方可实施。
2 跟踪审查:
修正案审查申请:以前经伦理委员会批准的项目,在研究实施过程中若变更主要研究者、对研究方案、知情同意书、招募材料等任何修改,都应向伦理委员会提交修正案审查申请,经批准后方可执行。为避免研究对受试者的即刻危险,研究者可在伦理委员会批准前修改研究方案,事后及时将修改方案的情况及原因,以“修正案审查申请”的方式及时提交伦理委员会。
研究进展报告:应按照伦理审查批件/通知规定的年度/定期跟踪审查频率,在截至日期前1个月提交研究进展报告;申办者应向组织单位伦理委员会提交各中心研究进展报告汇总;当出现任何可能显著影响研究进行或增加受试者危险的情况时,应以“研究进展报告”或者“安全性信息报告”的方式,及时报告伦理委员会。如果伦理审查批件有效期到期,需要延长批件有效期,应通过“研究进展报告”申请。
严重不良事件报告(SAE):严重不良事件,指受试者接受试验用药品后出现死亡、危及生命、永久或者严重的残疾或者功能丧失、受试者需要住院治疗或者延长住院时间,以及先天性异常或者出生缺陷等不良医学事件。
可疑且非预期严重不良反应报告(SUSAR),指临床表现的性质和严重程度超出了试验药物研究者手册、已上市药品的说明书或者产品特性摘要等已有资料信息的可疑并且非预期的严重不良反应。
违背方案报告/偏离方案报告:需要向伦理委员会报告的违背方案情况包括:①重要的违背方案:研究纳入了不符合纳入标准或符合排除标准的受试者,符合中止试验规定而未让受试者退出研究,给予错误治疗或剂量,给予方案禁止的合并用药等情况;或可能对受试者的权益和健康、以及研究的科学性造成显著影响的情况。②持续违背方案(指同一事件反复发生3次或3次以上),或研究者不配合监查/稽查,或对违规事件不予以纠正。③方案所定义的需向伦理委员会报告的违背方案情况。发现违背方案的情况应及时向伦理委员会报告。为避免研究对受试者的即刻危险,研究者可在伦理委员会批准前偏离研究方案,事后应及时向伦理委员会报告任何偏离已批准方案之处并作解释。
涉及受试者及他人风险的非预期问题报告:如非预期的不良事件、重要的非预期问题、研究新进展等问题。
暂停/终止研究报告:研究者/申办者暂停或提前终止临床研究,应及时向伦理委员提交暂停/终止研究报告。
研究完成报告:完成临床研究,应及时向伦理委员会提交结题报告。
3.复审
复审申请:上述初始审查和跟踪审查后,按伦理审查意见“必要的修改后同意”,对方案进行修改后,应以“复审申请”的方式再次送审,经伦理委员会批准后方可实施;如果对伦理审查意见有不同的看法,可以“复审申请”的方式申诉不同意见,请伦理委员会重新考虑决定。
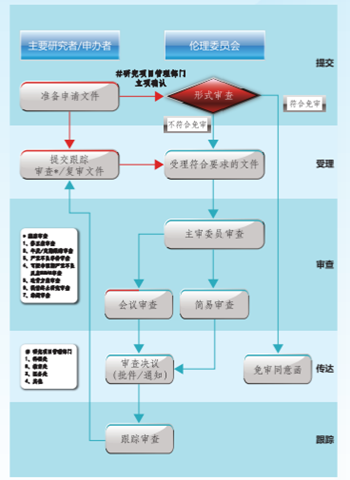
三、提交伦理审查的流程
1.提交送审文件
准备送审文件:根据送审文件清单(ER.01.01 送审文件清单及ER.19.01 联盟申请文件清单),准备送审文件;方案、知情同意书、招募广告(如果有)、研究者手册(如果有)、受试者日记卡(如果有)、病例报告表/研究病历应注明版本号和版本日期。
请根据需要下载参考文件夹1 伦理初审申请模板-注册类项目;参考文件夹2 伦理初审申请模板-科研项目;参考文件夹3 动物实验 ;参考文件夹4:新技术申请;参考文件夹5:动物预实验申请.
填写申请/报告的表格:根据伦理审查申请/报告的类别,填写相应的“申请”(初始审查申请书,修正案审查申请,复审申请),或“报告”(年度/定期跟踪审查报告,严重不良事件报告,违背方案报告,暂停/终止研究报告,结题报告。【已有伦理审查系统密码和账号者,可登陆系统填写即可】
提交:①首先准备完整的一套纸质送审文件,纸质版研究方案必须请主研确认签字,递交伦理办公室进行形式审查,伦理办公室会一次性将缺失文件和形式审查中的问题告知。②通过形式审查后请申请人将所有资料请主要研究者签字,如果为横向项目或项目请申办方/合同研究组织(如果有)盖章后上传系统,③伦理办公室将在系统正式受理,【注意:不完整的资料将不被受理】并签收电子受理通知书。【伦理委员会只受理电子版资料,不再受理纸质版资料,请务必确保并自行保存完成的纸质版资料】
提交系统时请注意:提交主要研究者履历的信息应包含近三年的所有培训、参加研究的情况;会议汇报的幻灯【请会前三天提交系统】、缴费信息【请缴费后尽快上传系统转账凭证和开票信息】等;所有提交伦理审查申请的主要研究者,每年度还需按照药物临床试验机构办公室的要求提交资质证明文件复印件,GCP培训证书复印件。
*注,每项研究的初始审查申请时都应提交研究团队经济利益冲突声明,以及其他利益冲突的声明,并请所有参研人员签字确认。
2.会议审查
会议时间/地点:参照会议审查时间,办公室工作人员/秘书将在会前一周内电话/短信通知。会议一般采取线上或线下的方式。
会议当天:请申请人或其委托人【申请人亲笔签署的书面委托函】做5-8分钟会议报告:在申请项目开始汇报答辩前5分钟到达会场【进入线上会议等候室】,报告项目;正面、简洁回答委员提问。如不能到会者,请
下载委托函,请主要研究者亲笔签署后携带至会场。
答辩结束后离开会场/线上会议室。
3.接收/查询会议审查结果:伦理办公室将于会议审查后的三个工作日内在审查系统传达伦理审查决定,并以电话/邮件/微信等方便的形式告知审查结果及具体意见/建议。
4.递交跟踪审查的资料:参照伦理审查的结果,修改相应的资料,并按要求提交伦理审查系统。
5.接收/查询审查决定/批件,会议审查的项目,会议后3个工作日可在伦理系统查询审查结果,并联系伦理办公室取纸质版决定;简易审查的项目,在完整递交并签收受理通知书后3-5个工作日可在伦理系统查询审查结果,同时可联系伦理办公室取纸质版决定;。
四、伦理审查的类别
伦理委员会一般有会议审查、紧急会议审查、简易程序审查三种形式。
【会议审查】:伦理委员会审查以会议审查为主要审查方式。
【简易审查】:有下列情形之一的,可实施简易审查:(一)研究风险不大于最小风险的研究;(二)已批准的研究方案作较小修改且不影响研究风险受益比的研究;(三)已批准研究的跟踪审查;(四)多机构开展的研究中,参与机构的伦理审查委员会对牵头机构出具伦理审查意见的确认等。由一至两名委员负责审查。简易审查同意的试验项目应在下一次伦理委员会会议上通报。
有下列情形之一的,简易审查项目应转入会议审查:①研究的风险受益比变化;②两名委员的意见不一致,且有重大调整;③委员提出需要会议审查。
对于北京市伦理审查联盟项目的审查,作为北京市伦理审查联盟成员单位,遵照相关制度执行,优先采用简易审查程序:组长单位如果符合以下四个条件之一,即可进行简易程序审查:四个条件主要是:1获得国家药监局认可的药物临床试验机构资质10年以上,2获批国家医学中心或国家临床医学研究中心;3完成国家科技重大专项和国家重点研发计划支持的项目;4伦理委员会连续三年每年都审查过三项本机构牵头的多中心临床研究。【只要符合条件之一,我院就可以认可他们的审查结果,优先进入简易审查程序。】
【紧急会议审查】:对于情况紧急的,可以向伦理委员会办公室提出进行紧急会议审查;在疫情暴发等突发事件紧急情况下,伦理委员会一般在48-72小时内召开紧急会议审查,并及时出具审查意见。
五、伦理审查的时间
伦理委员会每月例行召开涉及人体的研究项目的审查会议1-2次,每2个月至少召开一次动物伦理审查会议,每年度年终时对第二年的全年会议时间进行计划,并在官网公布。必要时可以增加审查会议次数。伦理委员会办公室受理送审文件后,一般需要1周的时间进行送审处理,并会在会议审查1周前告知伦理申请人准确的会议时间。如需要尽快召开或紧急召开会议,请联系伦理办公室。
六、审查决定的传达
伦理审查的所有决定都将通过伦理审查系统传达。
伦理委员会办公室在做出伦理审查决定后1-2个工作日内,以“伦理审查批件”或“伦理审查意见”的书面形式传达审查决定。申请人也将接到伦理办公室电话/短信/邮件/微信告知伦理审查结果。
如果审查意见为肯定性决定(同意继续研究,或不需要采取进一步的措施),并且审查类别属于(本院为多中心临床试验的参加单位,并且不涉及需要延长批件有效期的)年度/定期跟踪审查,严重不良事件审查,违背方案审查,暂停/终止研究审查,结题审查,以及上述审查类别审查后的复审,伦理委员会的决定可以直接以意见函形式传达。
伦理审查批准的标准:
(一)研究具有科学价值和社会价值,不违反法律法规的规定,不损害公共利益;
(二)研究参与者权利得到尊重,隐私权和个人信息得到保护;
(三)研究方案科学;
(四)研究参与者的纳入和排除的标准科学而公平;
(五)风险受益比合理,风险最小化;
(六)知情同意规范、有效;
(七)研究机构和研究者能够胜任;
(八)研究结果发布方式、内容、时间合理;
(九)研究者遵守科研规范与诚信。
七、伦理审查的费用
伦理委员会通过伦理咨询费的形式向参与审查工作的伦理委员/工作人员支付费用;药物临床试验和医疗器械临床试验的伦理审查费用由申办者向院财务处直接支付;科研项目从项目经费中划拨至伦理科目;伦理审查费归医院财务处统一管理;紧急会议审查项目费用增加1倍(含税)
| 项目类别 | 伦理审查(含复审)费(含税) | 备注 |
| 新药(I~Ⅳ,上市后药物评价)项目 | 组长单位:5350元 参加单位:3200元 | 有申办方参与项目的跟踪审查(如严重不良事件、修正案审查等)每次审查费用为1600元 无申办方参与项目的跟踪审查(如严重不良事件、修正案审查等)每次审查费用为500元 支付每个委员的咨询费以100元/项(科研)、200元/项(新药、器械类、委托),主审100元/项。 |
| 体外诊断试剂/医疗器械试验 | 3200元 | |
| 本院科研项目(包括人体试验和动物实验) | 纵向课题:1600元 横向课题(有申办方参与):3200元 | |
| 外院委托项目 | 5350元 | 跟踪审查若符合简易审查的标准,每次审查费用1600元,若不符合简易审查需会议审查者,收取审查费用3200元。 |
八、免除知情同意
1.利用以往临床诊疗中获得的医疗记录和生物标本的研究,并且符合以下全部条件,可以申请免除知情同意:
研究目的是重要的。
研究对受试者的风险不大于最小风险。
免除知情同意不会对受试者的权利和健康产生不利的影响。
受试者的隐私和个人身份信息得到保护。
若规定需获取知情同意,研究将无法进行(病人/受试者拒绝或不同意参加研究,不是研究无法实施、免除知情同意的证据)。
只要有可能,应在研究后的适当时候向受试者提供适当的有关信息。
若病人/受试者先前已明确拒绝在将来的研究中使用其医疗记录和标本,则该受试者的医疗记录和标本只有在公共卫生紧急需要时才可被使用。
2、利用以往研究中获得的医疗记录和生物标本的研究(研究病历/生物标本的二次利用),并且符合以下全部条件,可以申请免除知情同意:
以往研究符合原知情同意,并允许其他的研究项目使用其病历或标本;
本次研究符合原知情同意的许可条件;
受试者的隐私和身份信息的保密得到保证。
九、免除知情同意书签字
以下两种情况可以申请免除知情同意签字:
当一份签字的知情同意书会对受试者的隐私构成不正当威胁,联系受试者真实身份呢和研究的唯一记录是知情同意文件,并且主要风险就来自于受试者身份或个人隐私的泄露。在这种情况下,应该遵循每一位受试者本人的医院是否签署书面知情同意文件。
研究对受试者的风险不大于最小风险,并且如果脱离了“研究”背景,相同情况下的行为或程序不要求签署书面知情同意。例如:访谈研究,邮件/电话调查。
十、免除伦理审查
使用人的信息数据或者生物样本开展以下情形的涉及人的生命科学和医学研究,不对人体造成伤害、不涉及敏感个人信息或者商业利益的,可以免除伦理审查,以减少科研人员不必要的负担,促进涉及人的生命科学和医学研究开展。
(1)利用合法获得的公开数据,或者通过观察且不干扰公共行为产生的数据进行研究的;
(2)使用匿名化的信息数据开展研究的;
(3)使用已有的人的生物样本开展研究,所使用的生物样本来源符合相关法规和伦理原则,研究相关内容和目的在规范的知情同意范围内,且不涉及使用人的生殖细胞、胚胎和生殖性克隆、嵌合、可遗传的基因操作等活动的;
(4)使用生物样本库来源的人源细胞株或者细胞系等开展研究,研究相关内容和目的在提供方授权范围内,且不涉及人胚胎和生殖性克隆、嵌合、可遗传的基因操作等活动的。
免除伦理审查的表格请向伦理办公室获取,请携带该项目所有纸质资料前往伦理委员会,以便伦理秘书判断是否可以适用该类别的审查。
十一、联系方式
中国中医科学院西苑医院医学伦理委员会办公室电话:010-62835646
联系人:贾敏
文件下载请前往本页面“三、提交伦理审查的流程”
伦理审查系统网址:https://www.xiyuanirb.com:90/
十二、受试者沟通
临床研究协调员办公室:010—62835650
伦理委员会办公室:010—62835646
附件6:伦理审查工作时间安排
伦理系统提交资料时间:会前两周 | 2025年度会议时间(会议审查周三下午) |
简易审查程序(部分初审、修正案、违背方案、SAE、SUSAR审查等) | 2025年1月8日(A)\22日(B) |
*每次会议原则上为下午1:30 |
*伦理办公室电话:010-62835646
传真:010-62835646
*伦理委员会办公室对外接收资料及面访时间:每周一、二、三全天。周四、五为整理内部资料时间。